

Disponible en: ![]() -
- ![]() -
- ![]() -
- ![]() -
- ![]() -
- ![]() -
- ![]() -
- ![]()
1. NOMBRE DEL PRODUCTO
ODDONTOLIDO 36 MG X 0.018MG/1.8 ML SOLUCIÓN INYECTABLE
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Composición por cárpul:
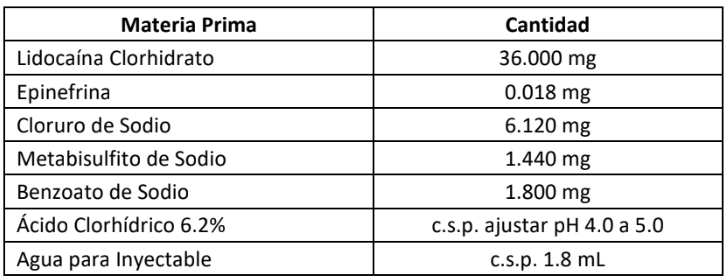
Excipiente(s) con efecto conocido: Cada ml también contiene 0.800 mg de metabisulfito de sodio, 1.000 mg de Benzoato de sodio y 1.686 mg/ml de sodio.
3. FÓRMULA QUÍMICA DE LOS PRINCIPIOS ACTIVOS
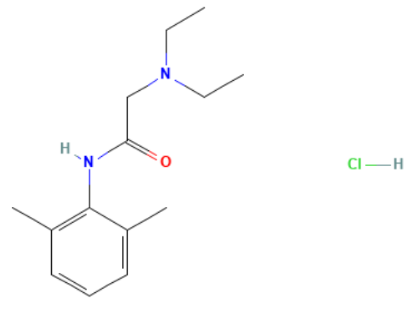
LIDOCAINA CLORHIDRATO
- Nombre DCI: LIDOCAINA CLORHIDRATO
- Tipo: Anestésico local tipo amida terciaria
- Nombre Químico: 2-(dietilamino)-N-(2,6-dimetilfenil)acetamida; clorhidrato
- Empírica: C14H23ClN2O
- Desarrollada:
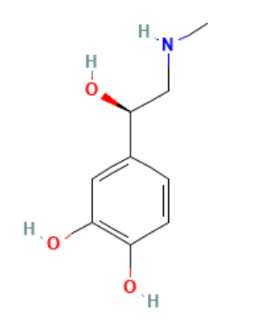
EPINEFRINA BASE
- Nombre DCI: EPINEFRINA BASE
- Tipo: Vasoconstrictor
- Nombre Químico: 4-[(1R)-1-hidroxi-2-(metilamino)etil]benceno-1,2-diol
- Fórmula Empírica: C9H13NO3
- Desarrollada
4. FORMA FARMACEÚTICA
Solución Inyectable
5. DATOS CLINICOS
5.1 Indicaciones terapéuticas
ODDONTOLIDO 36 MG X 0.018MG/1.8 ML SOLUCIÓN INYECTABLE es un anestésico local indicado en procedimientos dentales de infiltración o bloqueo nervioso.
5.2 Posología y forma de administración
Vía de administración: Local
Posología
Como con cualquier anestésico local, las dosis varían dependiendo de la zona de la anestesia, de la vascularización de los tejidos, del número de segmentos nerviosos que han de ser bloqueados, de la tolerancia del individuo (grado de relajación muscular y estado del paciente) y la técnica y profundidad de la anestesia. Se debe utilizar la dosis más baja que produzca una anestesia eficiente. La dosis necesaria debe ser determinada individualmente.
Adultos:
La dosis máxima recomendada de lidocaína es de 7 mg/kg de peso corporal para un adulto sano de 70 Kg. La dosis total inyectada en todas las áreas, distribuida en una sesión dental, no debe exceder la dosis máxima absoluta de 500 mg de lidocaína o 0,2 mg de epinefrina, sea cual sea la menor de ambas cantidades (8,9 cartuchos de 1,8 ml)
Por lo tanto, la dosis de epinefrina es la dosis limitadora sea cual sea el peso:

La dosis media recomendada que se debe emplear está en el intervalo de 36 mg a 72 mg de hidrocloruro de lidocaína por sesión.
Dosis pediátrica:
La dosis debe ser determinada individualmente por el profesional basado en el peso y la edad del paciente.
ODDONTOLIDO 36 MG X 0.018MG/1.8 ML SOLUCIÓN INYECTABLE está indicado en adultos, adolescentes y niños. Se debe actuar con una precaución especial al tratar a niños menores de 4 años. La cantidad para inyectar debe ser determinada por la edad y el peso del niño y por el alcance de la operación. La técnica de la anestesia debe ser elegida meticulosamente. Se deben evitar las técnicas de anestesia dolorosas. El comportamiento de los niños durante el tratamiento debe ser supervisado meticulosamente.
La dosis media que se debe emplear está en el intervalo de 20 mg a 30 mg de hidrocloruro de lidocaína por sesión. La dosis media en mg de hidrocloruro de lidocaína que puede ser administrada a niños puede ser calculada en su lugar por la siguiente fórmula: peso del niño (en kilogramos) x 1.33.
No se debe sobrepasar el equivalente de 5 mg de hidrocloruro de lidocaína por kilogramo de peso corporal. El número de cartuchos correspondiente a la dosis máxima de 5 mg/kg puede ser calculado de la manera siguiente:
Peso del paciente (kg) x dosis máxima de lidocaína (5 mg/kg) / cantidad de lidocaína por cartucho (36 mg)
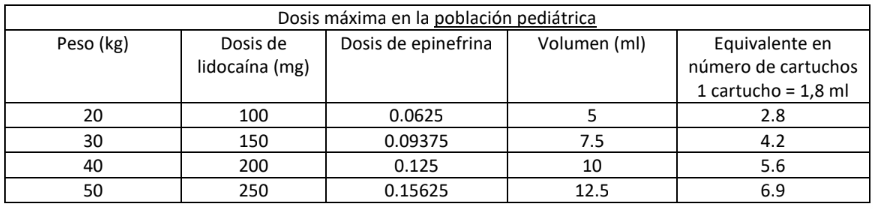
Para administración a pacientes pediátricos en concentraciones más bajas que las comercialmente existentes, diluir la concentración disponible con la cantidad de inyección de cloruro de sodio al 0.9% necesario para obtener la concentración final de la solución anestésica local.
Forma de administración
Para uso exclusivo local en anestesia dental. Infiltración y vía perineural en la cavidad bucal.
No se debe administrar por vía intravenosa.
Antes de la inyección, siempre se recomienda la aspiración para evitar la inyección intravascular.
Las reacciones sistémicas importantes como resultado de la inyección intravascular accidental pueden ser evitadas en la mayoría de los casos por una técnica de inyección después de la aspiración con una inyección lenta. La velocidad de inyección no debe superar 1 ml de solución por minuto.
Para evitar el riesgo de la inyección (p.ej. transmisión de la hepatitis), la jeringuilla y las agujas empleadas para retirar la solución siempre deben ser nuevas y estériles.
Para un único uso. Toda la solución que no haya sido utilizada deberá ser desechada.
El medicamento no debe ser utilizado si está turbio o decolorado.
Para más información relativa al manipulado del producto, véase la sección 7.6.
5.3 Contraindicaciones
- Hipersensibilidad a los principios activos, lidocaína y epinefrina, o a alguno de los excipientes
incluidos en la sección 7.1. - Hipersensibilidad a cualquier agente de anestesia local.
Debido a la lidocaína
- Trastornos graves de la conducción cardiaca (p.ej. bradicardia grave, bloqueo AV de segundo y
tercer grado); - Porfiria aguda intermitente;
- Paciente epiléptico con control insuficiente.
Debido a la epinefrina:
- Hipertensión descontrolada/grave;
- Enfermedad cardíaca isquémica grave;
- Taquiarritmia persistente/refractaria;
- Tirotoxicosis;
- Feocromocitoma.
5.4 Advertencias especiales y precauciones de uso
Como todos los agentes anestésicos locales, la lidocaína puede provocar efectos tóxicos agudos sobre los sistemas cardiovascular y nervioso central cuando su uso da lugar a altas concentraciones en sangre, especialmente después de una administración intravascular extensa.
Se debe tener precaución en el tratamiento de las siguientes categorías de pacientes:
Pacientes con trastornos cardiovasculares:
- Enfermedad vascular periférica
- Arritmias, especialmente de origen ventricular;
- Insuficiencia cardíaca;
- Hipotensión.
El producto debe ser administrado con precaución en pacientes con deficiencia cardíaca, ya que pueden ser menos capaces de compensar los cambios debido a la prolongación del conducto atrioventricular.
Pacientes con enfermedad renal: Se debe utilizar la dosis más baja que produzca una anestesia efectiva.
- Indagar en la diátesis del paciente, las terapias en curso y el historial;
- Mantener contacto verbal con el paciente;
- Disponer de un equipo de resucitación a mano (véase sección 5.9).
5.5 Interacción con otros medicamentos y otras formas de interacción
- Interacciones debidas a la presencia de epinefrina
Uso concomitante no recomendado:
- Medicamentos que potencian los efectos cardiovasculares de la epinefrina:
Los agentes bloqueantes adrenérgicos postganglionares (p.ej., guanadrel, guanetidina y alcaloides de rauwolfia) inhiben la captación de catecolaminas y/o aumentan la capacidad de respuesta de los tejidos diana. Se deben utilizar dosis reducidas de ODDONTOLIDO 36 MG X 0.018MG/1.8 ML SOLUCIÓN INYECTABLE bajo una supervisión médica estricta seguida por una aspiración meticulosa debido al riesgo de hipertensión y otros efectos cardiovasculares de la epinefrina.
Interacciones que requieren precauciones de uso:
Medicamentos que potencian los efectos cardiovasculares de la epinefrina:
Se deben reducir la dosis y la velocidad de administración de ODDONTOLIDO 36 MG X 0.018MG/1.8 ML SOLUCIÓN INYECTABLE debido al riesgo de hipertensión y de efectos arritmogénicos. Se recomienda una estrecha monitorización cardiovascular.
-
Los antidepresivos tricíclicos (p.ej., amitriptilina, desipramina, imipramina, nortriptilina, maprotilina y protriptilina) o los fármacos que combinan un efecto adrenérgico y serotoninérgico (p.ej., venlafaxina, milnacipran, sertralina) bloquean la captación de catecolaminas de los terminales nerviosos simpáticos.
-
Los inhibidores de MAO [tanto inhibidores A selectivos de MAO (p.ej., brofaromina, moclobemida, toloxatona) e inhibidores no selectivos de MAO (p.ej., fenelzina, tranilcipromina, linezolida)] o los inhibidores de catecol-O-metil transferasa (COMT) (p.ej., entacapona, tolcapona) inhiben el metabolismo de las catecolaminas.
Medicamentos que potencian los efectos vasopresores de la epinefrina:
Se debe reducir la dosis de administración de ODDONTOLIDO 36 MG X 0.018MG/1.8 ML SOLUCIÓN INYECTABLE debido al riesgo de hipertensión. Se recomienda una estrecha monitorización cardiovascular.
-
Los agentes bloqueantes beta-adrenérgicos no selectivos (p.ej., propranolol, nadolol) bloquean el beta componente vasodilatador de la epinefrina, dejando un efecto vasoconstrictor alfa-adrenérgico sin oposición.
-
Los agentes beta-adrenérgicos no selectivos también pueden aumentar la concentración plasmática de lidocaína.
-
Vasopresores simpaticomiméticos:
(p.ej., principalmente cocaína, pero también anfetaminas, fenilefrina, pseudoefedrina, oximetazolina) y otros simpaticomiméticos (p.ej., isoproterenol, levotiroxina, metildopa, antihistamínicos como la clorofeniramina, difenidramina): Existe un riesgo de toxicidad adrenérgica. Si se ha tomado cocaína durante las últimas 24 horas, se debe posponer el tratamiento dental previsto. -
Fármacos oxitócicos de tipo ergot (p.ej., metilsergida, ergotamina, ergonovina):
Utilice ODDONTOLIDO 36 MG X 0.018MG/1.8 ML SOLUCIÓN INYECTABLE bajo vigilancia médica estricta debido a los incrementos aditivos o sinergísticos de la presión sanguínea y/o de la respuesta isquémica.
Medicamentos que pueden causar disritmias ventriculares:
Se debe reducir la dosis de administración de ODDONTOLIDO 36 MG X 0.018MG/1.8 ML SOLUCIÓN INYECTABLE debido al riesgo de arritmia ventricular grave.
-
Anestésicos volátiles halogenados (p.ej., halotano): Potenciación del potencial disrítmico de las catecolaminas. El estado hemodinámico del paciente debe ser vigilado de cerca.
-
Los antiarrítmicos como la digitalis o la quinidina pueden causar efectos arritmogénicos aditivos. Se recomienda la aspiración meticulosa antes de la administración y la vigilancia cardiovascular (ECG).
Medicamentos que inhiben los efectos vasopresores de la epinefrina:
-
Las fenotiazinas y otros neurolépticos bloquean la actividad alfa-adrenérgica de la epinefrina. Se recomienda la utilización bajo supervisión médica estricta y vigilancia cardiovascular en caso de pacientes con hipotensión.
- Interacciones debidas a la presencia de lidocaína
Interacciones que requieren precauciones de uso:
-
Otros anestésicos locales:
La lidocaína se debe utilizar con precaución en pacientes tratados concomitantemente con otros productos para anestesia local, ya que los efectos tóxicos son aditivos (riesgo de sobredosis).La dosis total de la lidocaína administrada no debería superar la dosis máxima recomendada. -
Sedantes opiáceos:
En caso de administración concomitante, se deben utilizar dosis reducidas de Xylonor 2% Especial debido al posible efecto depresor aditivo sobre el sistema nervioso central de la lidocaína y de los sedantes. -
Inhibidores de la CYP1A2:
La lidocaína se metaboliza principalmente por la enzima CYP1A2. Los inhibidores de este citocromo (por ejemplo, ciprofloxacina, enoxacina, fluvoxamina) pueden disminuir su metabolismo, aumentar el riesgo de efectos adversos y contribuir a niveles sanguíneos de lidocaína prolongados o tóxicos. También se ha notificado un aumento de los niveles séricos de anestésicos amídicos después de la administración concomitante de cimetidina, lo que probablemente se deba al efecto inhibitorio de la cimetidina sobre la CYP1A2. Se recomienda precaución al asociar Xylonor 2% Especial con estos medicamentos, ya que el mareo puede durar más tiempo (ver sección 4.7). -
Agentes bloqueantes beta-adrenérgicos no selectivos (p.ej., propranolol):
Pueden aumentar las concentraciones plasmáticas de lidocaína al reducir el flujo sanguíneo hepático e inhibir la CYP1A2. Se debe tener precaución cuando la lidocaína y los beta-bloqueadores no selectivos se administran concomitantemente. Los agentes bloqueadores beta-adrenérgicos no selectivos también pueden potenciar los efectos vasopresores de la epinefrina. Se recomienda una estrecha monitorización cardiovascular.
5.6 Fertilidad, embarazo y lactancia
Embarazo
No se han anticipado efectos durante el embarazo, ya que la exposición sistémica a la lidocaína y a la epinefrina es insignificante. Este producto puede ser utilizado durante el embarazo. En los estudios en animales se han detectado efectos en la toxicidad para la reproducción con epinefrina a dosis superiores a las utilizadas a nivel clínico (ver sección 6.3).
Lactancia
La lidocaína y sus metabolitos son excretados con la leche humana, pero a dosis terapéuticas no se anticipan efectos sobre los recién nacidos y bebés durante la lactancia. Este producto puede ser utilizado durante la lactancia.
Fertilidad
Algunos estudios en animales han demostrado una disminución en la fertilidad femenina con epinefrina a dosis muy superiores a las utilizadas a nivel clínico (ver sección 6.3).
5.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de ODDONTOLIDO 36 MG X 0.018MG/1.8 ML SOLUCIÓN INYECTABLE sobre la capacidad para conducir y usar máquinas es pequeña. Pueden producirse mareos (incluido vértigo, trastornos de la visión y cansancio) después de administrar este producto (ver sección 5.8). Por tanto, los pacientes no deben salir de la consulta del dentista hasta pasados 30 minutos después del tratamiento dental.
5.8 Reacciones adversas
Resumen del perfil de seguridad
Las reacciones adversas después de la administración son similares a las que se observan con otros anestésicos de amida locales combinados con vasoconstrictores. Por lo general, estas reacciones adversas están relacionadas con la dosis y pueden derivar de elevados niveles de plasma causados por una sobredosis, la absorción rápida o la inyección intravascular involuntaria. También pueden derivar de la hipersensibilidad, la idiosincrasia o la tolerancia reducida por parte del paciente específico.
Los trastornos del sistema nervioso, los trastornos cardíacos y los trastornos vasculares son las reacciones adversas que se producen con mayor frecuencia.
Las reacciones adversas graves son generalmente sistémicas. La presencia de epinefrina aumenta el perfil de seguridad del producto debido a sus efectos simpaticomiméticos.
Tabla de reacciones adversas
Las reacciones adversas notificadas proceden de las notificaciones espontáneas, de los estudios clínicos y de la literatura.
La frecuencia de los signos iniciales de la toxicidad sobre el Sistema Nervioso Central y Cardiovascular se considera rara.
La La clasificación de las frecuencias se ajusta al siguiente convenio: Muy frecuentes (≥ 1/10), frecuentes (≥1/100 a <1/10), Poco frecuentes 1/1000 a < 1/100), Raras (≥1/10,000 a <1/1,000), Muy raras (<10,000) y frecuencia no conocida (no puede ser estimado basándose en los datos disponibles).
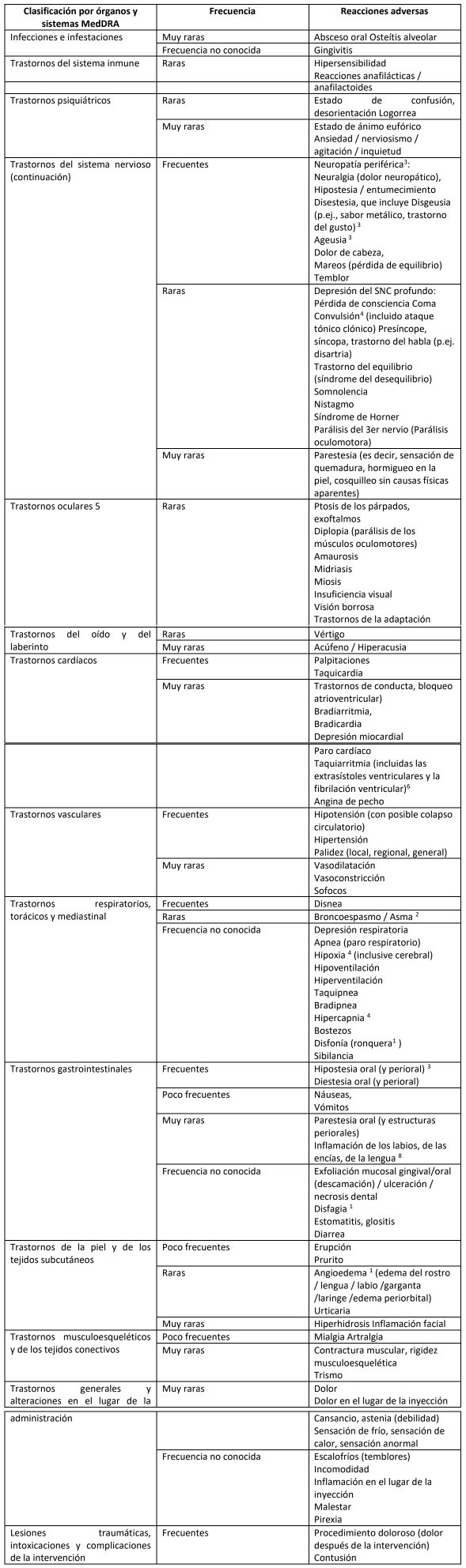
Descripción de las reacciones adversas seleccionadas
-
El angioedema incluye edema en el rostro, la lengua, los labios, la garganta, la laringe o periorbital. El edema laringofaríngeo puede producirse característicamente junto con ronquera o disfagia.
-
El broncoespasmo (broncocontracción) puede producirse característicamente con disnea.
-
Estas patologías neurales pueden producirse con síntomas diversos de sensaciones anormales (es decir, parestesia, hipostesia, disestesia, etc.) en los labios, la lengua y los tejidos bucales.
-
La hipoxia y la hipercapnia son secundarios a la depresión respiratoria o a los ataques y a los esfuerzos musculares prolongados.
-
Estos efectos con mediación neural se deben a la presencia de anestesia local/vasoconstrictor a concentraciones excesivas, ya sea regionalmente o en la circulación sistémica.
-
Esto se produce sobre todo en pacientes con enfermedad cardíaca subyacente o en aquellos que están tomando determinados fármacos (ver sección 4.5).
-
Esto se debe al efecto local excesivo del vasoconstrictor.
-
Esto se produce por morder accidentalmente o por mascar los labios o la lengua mientras dura la anestesia.
Debido a la presencia de epinefrina, las precauciones y el seguimiento deben ser incrementados en las situaciones siguientes: pacientes nerviosos antes del tratamiento dental. Cualquier conocimiento previo de este estado subyacente en los pacientes que requieren anestesia dental debería ser tomado en cuenta para utilizar una dosis mínima de anestesia local con vasoconstrictor.
Población pediátrica
La frecuencia, tipo y gravedad de las reacciones adversas en niños y adolescentes de 4 a 18 años es similar a la de los adultos.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas.
5.9 Sobredosis
Tipos de sobredosis
Una sobredosis de anestesia local en el sentido más amplio se utiliza con frecuencia para describir:
- Una sobredosis absoluta.
- Una sobredosis relativa:
- Inyección involuntaria dentro de un vaso sanguíneo.
- Absorción anormalmente rápida dentro de la circulación sistémica.
- Metabolismo y eliminación lentos del producto.
Sintomatología
-
Debido a la lidocaína:
Los síntomas dependen de la dosis y presentan una gravedad progresiva en el campo de las manifestaciones neurológicas, seguidos por toxicidad vascular, respiratoria y finalmente cardíaca (ver sección 4.8). -
Debido a la epinefrina:
Una sobredosis de epinefrina puede causar efectos cardiovasculares.
Tratamiento de la sobredosis
Se debe garantizar la disponibilidad del equipo de resucitación antes de la administración de anestesia dental con anestesia local. Si se sospecha la aparición de signos de toxicidad aguda, la inyección de este producto debe interrumpirse inmediatamente.
El oxígeno debería ser administrado rápidamente, si fuera necesario mediante ventilación asistida. Cambiar la posición del paciente a la posición supina si fuera necesario.
En caso de paro cardíaco, es necesario iniciar de inmediato la resucitación cardiopulmonar.
6. PROPIEDADES FARMACOLÓGICAS
6.1 Propiedades farmacodinámicas
Sistema nervioso / Anestesia / Anestesia local / Amidas / Lidocaína, combinaciones.
Código ATC: N01BB52
La lidocaína es un anestésico local de tipo amida. El efecto anestésico local de la lidocaína se produce a través del bloqueo reversible de la propagación del impulso de la fibra nerviosa.
La epinefrina potencia el efecto anestésico local de la lidocaína aumentando su retención en el lugar de la inyección.
6.2 Propiedades farmacocinéticas
Absorción
Los niveles máximos de plasma de la lidocaína 20 mg/ml después de las inyecciones periorales de soluciones combinadas de epinefrina durante las intervenciones dentales fueron determinados en diversos estudios clínicos. Cmax es de 1,9 mg/ml de lidocaína después de la inyección de 160 mg de lidocaína.
Distribución
Entre el 60% y el 80% de la lidocaína está unida a la alfa-1-glucoproteína ácida (AAG).
Metabolismo
La lidocaína se metaboliza principalmente en el hígado mediante el sistema del citocromo P450. El metabolismo hepático es rápido, y aproximadamente el 90% de una dosis administrada se convierte principalmente en monoetilglicinexilidida y glucinexilidida.
Eliminación
La lidocaína y sus metabolitos son excretados por los riñones, un 90% como metabolitos y un 10% como fármaco inalterado, con una vida media de 100 minutos.
6.3 Datos preclínicos sobre seguridad
Epinefrina
Se han detectado en hámsteres, a dosis de 20,3 veces la dosis máxima recomendada en humanos, alteraciones en la fertilidad (aumento de las pérdidas de preimplantación) y retrasos en la osificación. En ratas se han detectado efectos en el feto a dosis de 7,1 veces la dosis máxima recomendada en humanos (descenso del ritmo cardíaco, hipotensión y aumento de los niveles séricos de potasio). En conejos se produjo un descenso del peso al nacer.
Lidocaína
En los estudios en animales, los signos y síntomas de la toxicidad observada con dosis altas de lidocaína son el resultado de sus efectos sobre el sistema nervioso central y el aparato cardiovascular. Las pruebas de genotoxicidad con lidocaína no demostraron ninguna evidencia de potencial mutagénico; sin embargo, con su metabolito 2,6-dimetilanilina se observó una evidencia débil de actividad genotóxica. Este metabolito ha demostrado tener potencial carcinogénico, aunque no hay estudios de carcinogénesis con lidocaína.
No se observaron efectos en la toxicidad para la reproducción en ratas hembra y sus fetos a dosis intravenosas de hasta 11,5 veces la dosis máxima recomendada en humanos en base al área de superficie corporal.
7. INFORMACIÓN FARMACÉUTICA
7.1 Lista de excipientes
Cloruro de sodio
Metabisulfito de sodio
Benzoato de sodio
Ácido clorhídrico 6.2% (para el ajuste del pH)
Agua para inyectables.
7.2 Periodo de validez
24 meses.
7.4 Precauciones especiales de conservación
Manténgase fuera del alcance de los niños
Consérvese a temperatura inferior a 30°C y protéjase de la luz.
Venta bajo receta médica
7.5 Naturaleza y contenido del envase
Presentación comercial: Caja de cartón conteniendo 50 cárpules de vidrio de borosilicato tipo 1 de 1.8 mL
Muestra Médica: Carterita conteniendo 1 cárpul de vidrio de borosilicato tipo I de 1.8 mL.
7. TITULAR DE LA COMERCIALIZACIÓN
Fabricado por: New Stetic, S.A.
Para: Latin Farma S.A.
8. FECHA DE REVISIÓN DEL TEXTO
Noviembre 2022
9. REFERENCIAS
- La información detallada y actualizada de este medicamento está disponible en la página Web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) :
https://cima.aemps.es/cima/pdfs/es/ft/51081/FT_51081.pdf - La información de la estructura y nombre químico del principio activo Lidocaína Clorhidrato está disponible en: https://pubchem.ncbi.nlm.nih.gov/compound/6314
- La información de la estructura y nombre químico del principio activo Epinefrina base está disponible en: https://pubchem.ncbi.nlm.nih.gov/compound/5816
